ArcticZymes Technologies致力于提供高质量产品,具有良好的批间一致性、稳定可靠的质量、及时的文件及技术支持。ArcticZymes所有产品的开发、生产及销售等都符合ISO13485:2016质量管理体系标准;鉴于生物制品更严格的质控要求,厂家对盐活性核酸酶系列产品(Salt Active Nucleases,SANs)的生产及质控,在符合ISO13485:2016体系基础上,增加了cGMP相应要求,如生产用原辅料是Non-animal和Non-plant来源的,终产品经过0.22µm过滤sterilization,放行检测包括microbes、fungus及内毒检测等,所有标准符合USP-EP要求。M-SAN HQ ELISA Kit能够定量检测M-SAN HQ中盐核酸酶残留。黑龙江ArcticZymes中盐核酸酶70950-150
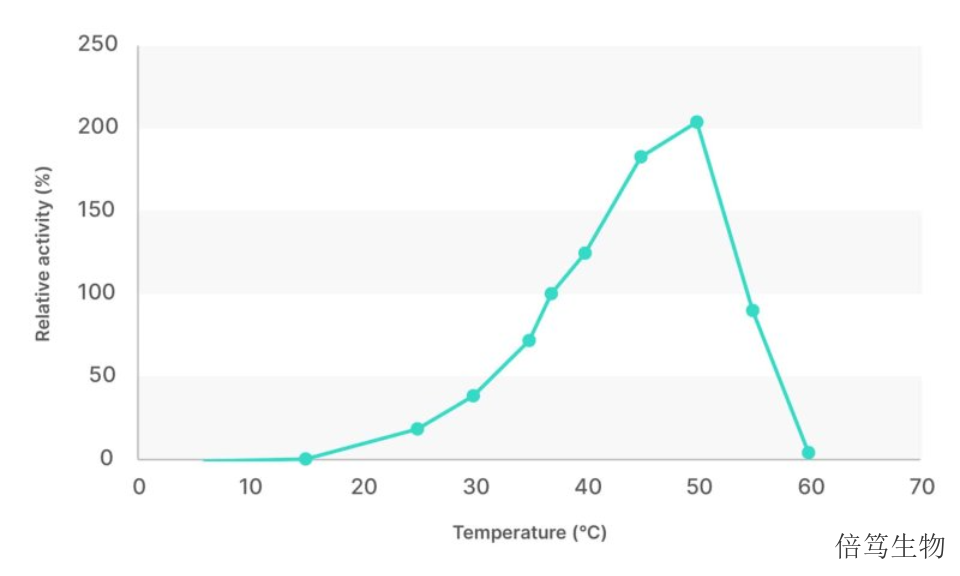
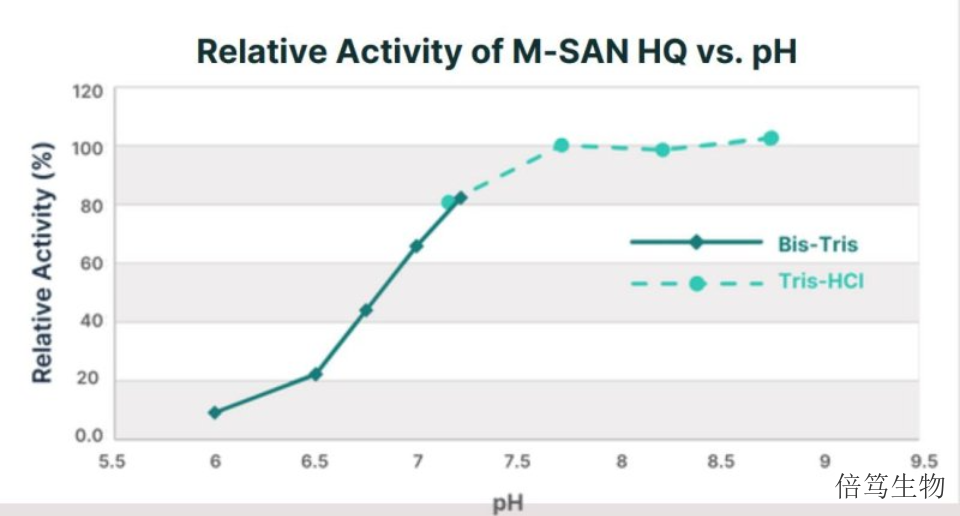
市售的M-SAN HQ中盐核酸酶有三个规格,分别是25kU、500kU及5MU,分别满足研发初期及大规模生产各阶段的要求。通过SDS-PAGE检测蛋白纯度在99%以上。基于ArcticZymes Technologies的30年的酶学开发及大规模生产经验,M-SAN HQ的生产体系稳定,产品纯度高,批次一致性好,无蛋白酶活性。厂家开发出特异的缓冲液体系,使M-SAN HQ保存起来更加稳定,-15℃ - -30℃条件下保存4年没有活性下降。研究数据表明,经过5-6次的反复冻融,M-SAN HQ中盐核酸酶活性没有明显变化。浙江中盐核酸酶70950M-SAN HQ中盐核酸酶不需调整培养基任何组分,使用简单方便;
残留的宿主DNA是生产中产生的杂质,其存在潜在的致瘤性、传染性和免疫原性等风险。相关研究表明,基因的大小普遍在200bp以上,因此大于200bp有可能会有一定的致病性,而且残留DNA片段越大,生物制品的风险等级越高。因此,各国监管机构对其提出了严格要求。美国食品药品监督管理局(FDA)在《关于人类基因zhiliao新产品生产指导文件》中明确指出HCD的片段要小于200bp。2022年5月,国家药品监督管理局药品评审中心(CDE)发布的《体内基因药物产品药学研究与评价技术指导原则(试行)》中也明确指出需对DNA残留量和残留片段大小进行控制,建议尽量将DNA残留片段的大小控制在200bp以下。
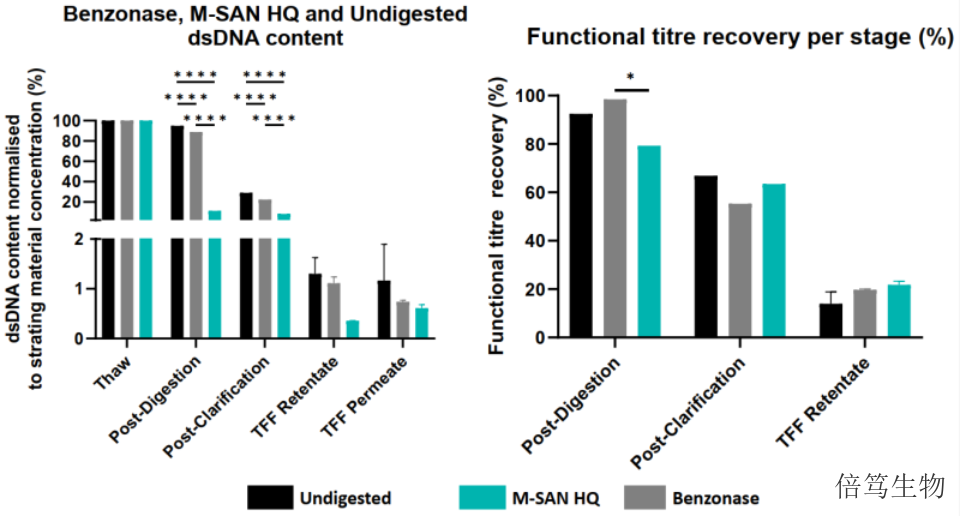
M-SAN HQ中盐核酸酶在生理盐条件下的优势,让其成为生物生产工艺中去除核酸污染的更好选择。经过多年的市场宣传,M-SAN HQ中盐核酸酶品质已得到多个全球TOP CDMOs认可,纳入其工艺开发筛选平台。此外,目前全球有10+临床项目涉及的病毒载体生产用到M-SAN HQ中盐核酸酶。对于同一个项目,用M-SAN HQ替代Benzonase全能核酸酶,酶量减少、HCD去除效果更优、病毒载体产量也有一定程度的提高,酶相关成本降为原有的1/5以内,极大降低了病毒载体生产成本。相比于全能核酸酶,在生理盐条件下M-SAN HQ中盐核酸酶将染色质DNA剪切成更小片段的效率更高。
对于含包膜的病毒载体,如慢病毒LV、逆转录病毒RV等,在细胞培养上清液中收获。而M-SAN HQ中盐核酸酶,作为市场上更适合生理盐条件的核酸酶,所以,M-SAN HQ成了包膜病毒载体生产的更好选择。优势在于:1. M-SAN HQ兼容多种细胞培养体系,在细胞培养盐浓度条件下具有更优活性;2. M-SAN HQ酶活更高、酶切速度更快,缩短孵育时间;3. M-SAN HQ能够高效剪切染色质到更小片段,简化下游工艺流程;4. 相比Benzonase,M-SAN HQ用量减少1/2-2/3,降低了酶用量及生产成本。中盐核酸酶能够将单链及双链的DNA及RNA,消化成5个碱基为主的寡核苷酸oligos。浙江中盐核酸酶70950
宿主细胞DNA主要以染色质形态存在,其中组蛋白通过离子作用及疏水作用与DNA紧密结合;黑龙江ArcticZymes中盐核酸酶70950-150
ArcticZymes Technologies成立于20世纪80年代后期,致力于从海洋生物中识别新的冷适应酶。ArcticZymes目标明确,推进分子研究、诊断和therapeutics领域的发展。30多年来,ArcticZymes只专注于酶学研究,汇集一批志同道合的科学家,在酶学领域追求zhuoyue、勇于创新。ArcticZymes开发创新解决方案,与客户紧密协作,提升产品品质,从高质量到zhuoyue,达成他们的目标,重新定义生物药生产的边界。在ArcticZymes,我们精心设计解决方案,以从未出现的方式推动行业向前发展。黑龙江ArcticZymes中盐核酸酶70950-150
大规模生产阶段,AAV/LV载体生产流程跟抗体、疫苗类药物的生产类似,主要包含上游培养、下游纯化及制...
【详情】残留的宿主DNA是生产中产生的杂质,其存在潜在的致瘤性、传染性和免疫原性等风险。相关研究表明,基因的...
【详情】宿主细胞DNA(HCD)残留以染色质形式存在,其中有带负电荷的DNA、带正电荷及疏水区段的组蛋白,就...
【详情】ArcticZymes Technologies致力于提供高质量产品,具有良好的批间一致性、稳定可靠...
【详情】宿主细胞DNA残留的担忧是基于致ai风险理论,特别是生产细胞系所包含的致ai序列,比如较常见腺病毒基...
【详情】ArcticZymes Technologies有两条产品线,分别针对分子诊断和生物药物生产两个领域...
【详情】ArcticZymes Technologies成立于20世纪80年代后期,总部位于挪威北部的特罗姆...
【详情】宿主细胞DNA(HCD)残留以染色质形式存在,其中有带负电荷的DNA、带正电荷及疏水区段的组蛋白,就...
【详情】M-SAN HQ中盐核酸酶在生理盐条件下的优势,让其成为生物生产工艺中去除核酸污染的更好选择。经过多...
【详情】上海倍笃生物科技有限公司(简称“倍笃生物”),由中国科学院及生物医药产业界人士,于2018年1月共同...
【详情】ArcticZymes Technologies推出了SAN HQ高盐核酸酶和M-SAN HQ中盐核...
【详情】ArcticZymes Technologies成立于20世纪80年代后期,总部位于挪威北部的特罗姆...
【详情】