脂质体配方中脂类的毒性由于LNPs主要由天然脂质组成,它们被认为是无药理活性和毒性**小的。然而,在某些情况下,LNP并非免疫惰性,而LNP成分是可能对人体细胞有毒的非天然化合物。例如,虽然阳离子脂质作为递送脆弱化合物(如核酸)的载体提供了巨大的希望,但一些阳离子脂质会引起细胞毒性。在某些情况下,阳离子脂质会减少细胞中的有丝分裂,在细胞的细胞质中形成液泡,并对关键的细胞蛋白如蛋白激酶c造成有害影响阳离子脂质的细胞毒性取决于它们的结构亲水头基团;具有季铵头基的两亲化合物比具有叔胺头基的两亲化合物毒性更大。疏水链对脂质毒性的影响还没有得到很好的研究,阻碍了低毒性脂质的设计。脂质分子的疏水部分强烈调节其相行为及其对LNP的有用性,但某些脂质相的存在也与膜损伤和细胞毒性有关。PEG-脂质偶联物也可能引起意想不到的毒性,而已知含有PEG-脂质偶联物的LNPs与免疫细胞相互作用,产生针对某些聚乙二醇化脂质的不想要的抗体。脂质与生物活性小分子(如叶酸)的结合已被研究用于靶向递送核酸。海南脂质体载药实验
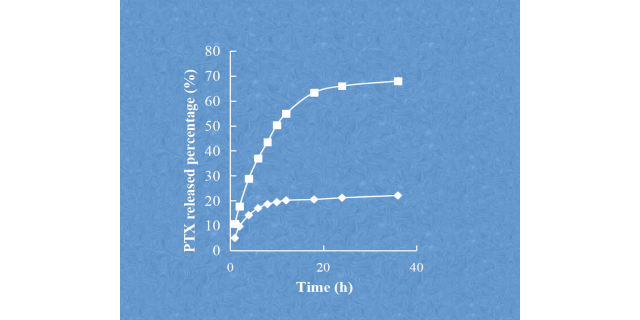
基于药代动⼒学机制和脂质体性质,脂质体的质量控制通常包括粒径和粒径分布、形态、层状结构、表⾯性质(zeta电位、PEGlated厚度和靶分⼦,如配体)、脂膜相变温度、载药效率、释放速率等。例如,脂质体的⽚层结构会影响药物的释放速度,⽽形态会影响脂质体在体内的循环时间。
健康组织和**组织之间的血管系统差异使EPR效应得以实现。反过来, 由于不太完美的细胞填充导致更多的泄漏性质, 血管在细胞中具有较大的间隙。 因此,脂质体通过逃离血管的被动靶向效应在**中积累。对几种不同**的被动靶向是由体内脂质体的大小和稳定性决定的。这可归因于它们的小尺寸延长了循环时间并在组织中外渗。因此,考虑到各种脂质体药理学研究的报告数据,可以得出结论,较小的脂质体有更多机会逃脱RES系统的非特异性摄取。 绿色荧光脂质体载药研发脂质体根据室室结构和层状结构可分为单层囊泡(ULVs)、寡层囊泡(OLVs)、多层囊泡(MLV)和多泡脂质体(MVLs)。

脂质体共价连接药物-脂质偶联载***式通过连接剂将药物分⼦与脂质共价连接是另⼀种在脂质体内装载药物的有效策略,例如Mepact。MDP是主要⾰兰⽒阳性菌细胞壁的组成部分,具有****应答的作⽤。由于MDP是⽔溶性低分⼦量分⼦,其脂质体在储存过程中存在包封效率低和药物泄漏等问题。为了提⾼MDP的脂溶性,通过肽间隔剂将MDP与PE连接,合成MTP-PE(muramyltripeptide-phosphatidylethanolamine)。在⽤⽣理盐⽔重建冻⼲产物(MTP-PE,POPC和OOPS)时,MTP-PE的两亲分⼦嵌⼊脂质体的膜双层。脂质体内存在MTP-PE,未发现游离MTP-PE。Vyxeos采⽤被动加载和主动加载相结合的⽅法,这是⾸个被批准在同⼀囊泡中加载两种不同药物(阿糖胞苷和柔红霉素)的脂质体。简⽽⾔之,当脂质泡沫与Cu(葡糖酸盐)2、三⼄醇胺(TEA)、pH7.4和阿糖胞苷溶液⽔合时,阿糖胞苷被被动地封装到脂质体中。经过减浆和缓冲液交换以去除未包封的药物和Cu(葡糖酸盐)2/TEA后,中性pH的柔红霉素缓冲液与载糖胞苷脂质体孵育。
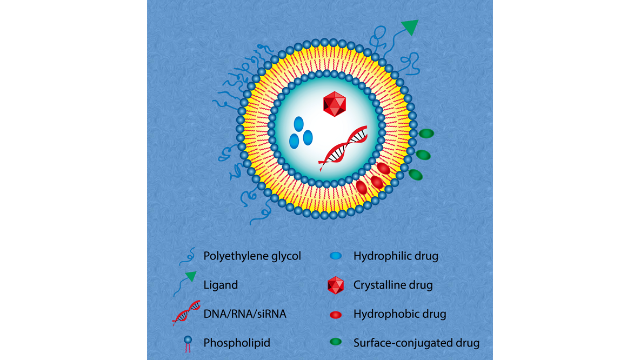
载药脂质体如何纯化如果需要纯化载药脂质体,通常会根据载药脂质体的性质和所需纯度要求选择合适的纯化方法。以下是一些可能的纯化方法:1.超滤法:超滤可以用于去除较大的杂质和未包埋的药物。通过选择适当的分子量截止膜,将载药脂质体溶液经过超滤膜,较大的杂质和未包埋的药物将被截留,而较小的载药脂质体颗粒则通过膜孔。2.凝胶过滤法:凝胶过滤可以利用凝胶材料的孔隙大小分离分子。将载药脂质体溶液加入到凝胶柱中,通过洗脱的方式,较小的载药脂质体颗粒会通过凝胶柱,而较大的杂质则会被截留在柱中。3.离心法:离心可以将载药脂质体颗粒沉淀到底部,去除上清液中的杂质和未包埋的药物。将载药脂质体溶液进行高速离心,使载药脂质体颗粒沉淀到离心管底部,然后去除上清液中的杂质和未包埋的药物。4.柱层析法:柱层析可以利用吸附剂对溶液中分子的亲和性分离。将载药脂质体溶液通过填充有吸附剂的柱子,通过洗脱的方式,使载药脂质体颗粒和杂质分离出来。5.其他方法:根据具体情况,还可以考虑其他纯化方法,如凝胶电泳法等。选择合适的纯化方法需要考虑载药脂质体的性质、所需纯度要求以及纯化效率等因素。通常会结合多种方法进行纯化,以达到所需的纯度和纯净度。脂质体是由多种组分构成的,主要包括:磷脂质、胆固醇、表面活性剂和PEG2000等。
脂质体制备方法:原位制备脂质体“原位”被认为是临床使⽤前形成的脂质体。Mepacthas的商业化产品就采⽤了这种⽅法进⾏⽣产。将药物和磷脂配制成散装溶液,过滤灭菌、灌装、冻⼲。在Mepacthas中,*包含三种成分,即活性成分胞壁三肽磷脂酰⼄醇胺(MTP-PE)、棕榈酰油酰磷脂酰胆碱(POPC)和⼆酰磷脂酰丝氨酸(OOPS),并按⼀定⽐例(POPC:OOPS=7:3,MTP-PE:磷脂=1:250)。该产品为⼲燥的脂质饼,具有多孔结构,为与体质介质接触提供了较⼤的表⾯积。临床使⽤前,在⼩瓶中加⼊0.9%的⽣理盐⽔溶液,将⼲燥物质⽔化,形成多层脂质体,粒径为2.0-3.5µm,粒径分布为单峰型。磷脂在⽔中的相变温度约为5℃,可以在室温下原位制备脂质体。脂质体配方中各脂类的毒性的研究。海南脂质体载药实验
由于AS-ODNs可以下调某些RNA并抑制靶蛋白的表达,因此它们被认为具有作为核酸药物的潜力。海南脂质体载药实验
脂质体中辅助脂质中性脂也经常被用作阳离子脂质体的助手。例如,已知中性脂质1,2-二油基-asn-甘油-3-磷酸乙醇胺(DOPE)在胞吞作用后参与内体逃逸,胆固醇(一种内源性脂质)可以插入脂质双层之间以增加纳米颗粒的刚性。为了增加体内稳定性,一种非常普遍的方法包括插入聚乙二醇(PEG)偶联的中性脂质,对纳米颗粒进行聚乙二醇化。此外,中性辅助性脂质,如DOPE已被用于提高阳离子脂质体的递送效率。DOPE提高核酸递送效率的生物物理机制仍在研究中。**近的一项研究报道,含有DOPE的脂质单层呈现不规则的豆状结构域,而缺乏DOPE的脂质单层呈现均匀的表面。除DOPE外,其他中性脂质,包括N-十二烷酰基肌氨酸,已被报道可提高阳离子脂质体的基因递送效率。海南脂质体载药实验