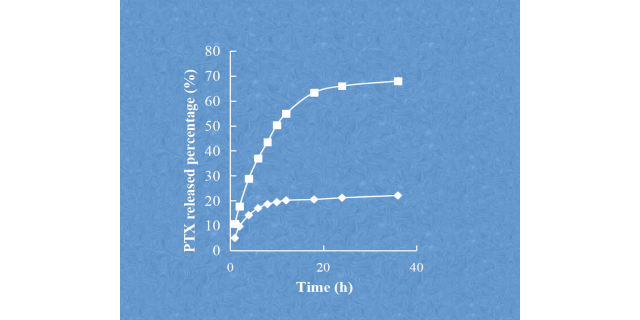
脂质体的粒径和粒径分布脂质体的整个药代动⼒学过程,如全⾝循环和MPS***、外渗到组织间质、细胞外基质间质运输以及细胞摄取和细胞内运输,都是依赖于尺⼨的。粒径<200nm的颗粒可降低⾎清蛋⽩的调理作⽤,降低MPS的***率。在⼩⿏⽩⾎病模型中,对于Myocet来说,较⼩的脂质体具有更⾼的抗**功效和增加的平均⽣存时间。粒径为2.0-3.5µm的Mepact可促使单核细胞/巨噬细胞吞噬,触发*****的免疫调节作⽤。Singh等⼈发现,含有不同颗粒⼤⼩的佐剂脂质体(ArmyLiposomeFormulation,ALF)的疫苗会产⽣不同的免疫反应,即树突状细胞更有效地摄取10-200nm范围内的⼩颗粒,⽽其他免疫细胞,如巨噬细胞,则倾向于吞噬⼤颗粒。Niu等⼈研究了⼝服给药的胰岛素负载脂质体,发现直径为150nm和400nm的脂质体表现出较慢且持续时间⻓达24⼩时的降糖作⽤,⽽粒径约为80nm和2µm的脂质体则分别表现出短暂且⽆药理作⽤。文献表明,对于*****的脂质体来说,小于200nm的脂质囊泡大小可以从物理肝脏筛选过程中逃逸。根据肝窦的大小,需要小于150nm的囊泡才能通过高渗透性的**血管穿透到恶性组织中。因此,它是由增强的渗透率(EPR)效应控制的,这有助于脂质体通过被动靶向在**中积累。一种含有DOPE的脂质制剂被发现可以增加各种细胞类型中GFP特异性siRNA的摄取。山东定做脂质体载药

非病毒载体通常具有比病毒载体更低的转染效率,但由于它们被认为要安全得多,因此已被***研究。纳米颗粒递送系统,其中阳离子脂质纳米颗粒通过核酸的负磷酸基团装载,是一类主要的非病毒载体,显示出高生产力和装载效率。用于携带核酸的纳米颗粒系统在整体上可分为基于脂质或聚合物的纳米颗粒,在与核酸相互作用后,每种纳米颗粒都被称为“脂质复合物”或“多聚体”。这些复合物的细胞递送被认为是通过内吞作用发生的,然后内体逃逸到细胞质中。阳离子脂质体作为核酸的一种传递系统,具有一定的优势。首先,阳离子脂质体在体内给药后是可生物降解的。内源性酶的存在可以分解脂质体的脂质成分。脂质体在各种纳米载体之间****的生物相容性导致在体内研究中使用阳离子脂质体递送各种sirna。脂质组成依赖性的表面电荷密度调节可以控制与带负电的核酸的相互作用力。聚乙二醇化脂质或功能性脂质的包含可以使脂质体的多种表面修饰成为可能。此外,在阳离子脂质体的脂质双层中包含亲脂性化学药物可以提供***药物和***性核酸的共递送。鉴于阳离子脂质体的优势,人们已经研究了阳离子脂质体用于递送各种核酸,如质粒DNA、反义寡核苷酸和siRNA。长循环脂质体载药研究Arg-Gly-Asp (RGD)肽修饰的脂质体增强核酸靶向整合素受体表达细胞传递的能力。
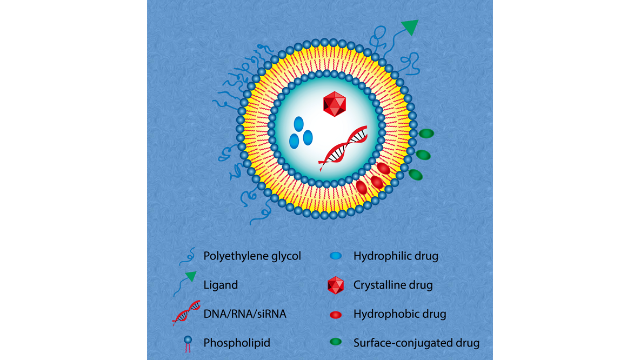
2脂质体的主要成分
⽢油磷脂(GP)、鞘磷脂(SM)和胆固醇(Chol)是市场上脂质体产品中使⽤的基本成分。GP含有⽢油,它连接⼀对疏⽔脂肪酸链和⼀个亲⽔极性头基。脂肪酸和极性头基团的类型。在⽣理pH下,不同的头部组提供负(PA、PS、PG和⼼磷脂)或中性(PC和PE)电荷的脂质体。带负电的DSPG⽤于AmBisome(注射⽤两性体脂质体),可与带正电的AmpB胺基相互作⽤,形成稳定的离⼦配合物,⽽⽤于Vyxeos的DSPG通过强⼤的库仑斥⼒使脂质体聚集**⼩。⽤于DaunoXome(柠檬酸柔红霉素脂质体注射液)、Onivyde(伊⽴替康脂质体注射液)和Vyxeos的DSPC是⼀种中性合成脂质,具有明确的脂肪酸组成(两分⼦硬脂酸)、⾼纯度和相对⾼的相转变(Tm为55◦C)。EPC作为赋形剂加⼊Myocet和Visudyne(维替泊芬粉为输液溶液)中。EPC是从蛋⻩中纯化的天然磷脂(NPL)。与半合成脂和合成脂相⽐,NPL的⽣产成本较低,但转变温度较宽,难以获得完全相同的NPL,并且脂质体可能存在批次差异。此外,EPC的不饱和脂肪酸导致了−15~−5◦C的低相变温度,表明脂质体双分⼦层在体温中处于⽆序和药物“漏出”状态。
利用设计的脂质,他们发现由1,2-二油醇-3-二甲基氨基-丙烷(DODMA)阳离子脂质组成的核酸脂质颗粒在小鼠和食蟹猴中分别以0.01mg/kg和0.3mg/kg的剂量包封siRNA时表现出基因沉默作用。**近的一项构效关系研究表明,脂质结构的细微差异可能导致转染效率的明显差异。作者设计并合成了1,4,7,10-四氮杂环十二烷环基和含咪唑的阳离子脂质,它们具有不同的疏水区域(例如,分别为胆固醇和双薯蓣皂苷配基)。结果表明,这两种阳离子脂质在HEK293细胞中诱导有效的基因转染。脂质与生物活性小分子(如叶酸)的结合已被研究用于靶向递送核酸。
脂质体配方中脂类的毒性由于LNPs主要由天然脂质组成,它们被认为是无药理活性和毒性**小的。然而,在某些情况下,LNP并非免疫惰性,而LNP成分是可能对人体细胞有毒的非天然化合物。例如,虽然阳离子脂质作为递送脆弱化合物(如核酸)的载体提供了巨大的希望,但一些阳离子脂质会引起细胞毒性。在某些情况下,阳离子脂质会减少细胞中的有丝分裂,在细胞的细胞质中形成液泡,并对关键的细胞蛋白如蛋白激酶c造成有害影响阳离子脂质的细胞毒性取决于它们的结构亲水头基团;具有季铵头基的两亲化合物比具有叔胺头基的两亲化合物毒性更大。疏水链对脂质毒性的影响还没有得到很好的研究,阻碍了低毒性脂质的设计。脂质分子的疏水部分强烈调节其相行为及其对LNP的有用性,但某些脂质相的存在也与膜损伤和细胞毒性有关。PEG-脂质偶联物也可能引起意想不到的毒性,而已知含有PEG-脂质偶联物的LNPs与免疫细胞相互作用,产生针对某些聚乙二醇化脂质的不想要的抗体。脂质体各组分对核酸递送效率的影响。长循环脂质体载药研究
脂质体的粒径和粒径分布的检测。山东定做脂质体载药
脂质体靶向递送中RGD配体修饰尽管阳离子脂质体具有在体内递送核酸的潜力,但其递送到特定靶点仍然是一个主要挑战。为了增强携带核酸的阳离子脂质体在靶组织中的分布,研究人员用多肽和小分子修饰了脂质体表面。例如,研究了Arg-Gly-Asp(RGD)肽修饰的脂质体增强核酸向整合素受体表达细胞传递的能力。负载P糖蛋白特异性siRNA的RGD修饰阳离子脂质体对整合素受体表达的人乳腺*MCF7/A细胞的递送率更高,导致P糖蛋白的***沉默。与此一致的是,分子成像显示,与小鼠模型的邻近正常组织相比,MCF7/A**组织中RGD修饰的阳离子脂质体和siRNA的分布更高。在**近的一项研究中,用环RGD和辛精氨酸修饰脂质体表面,以利用环RGD的整合素受体结合效应和辛精氨酸的细胞穿透效应。双配体修饰的阳离子脂质体增加了整合素avb3表达细胞的细胞摄取,并且更有效地转染荧光素酶编码质粒DNA。山东定做脂质体载药