EAE模型是由针对CNS髓鞘发生免疫攻击的CD4+Th1细胞介导的自身免疫性疾病,抗原致敏的T细胞穿过血脑屏障进入中枢,诱发对自身髓鞘抗原的免疫应答,导致脑及脊髓的免疫损伤。EAE是人类MS的经典动物模型,通过对EAE发病机制、病情发***展规律、临床及病理改变、***及预防等方面的深入研究,能够为MS的***提供充分的实验依据。词条图册EAE发病有多种诱发因素,包括食物、药物及***等。大鼠的饲养环境级别越高,清洁度越高,接触诱发因素的几率越小,在相同条件下致敏,其发病率就越低,因此选用普通动物即可。**近有报道说明,EAE的发病还与动物的血脑屏障的形成有关。EAE模型是实验动物通过神经组织(其中的某些成分)或病毒诱导产生的。湖南小鼠eae模型实验外包

MOG,英文全名Myelinoligodendrocyteglycoprotein,中文名髓鞘少突胶质细胞糖蛋白,髓鞘的一种微量成分,属于免疫球蛋白超家族成员之一。t也是特定表达于***系统(CNS)的自身抗原,诱导多发性硬化症的原发性脱鞘特征。MOG(35-55)是髓鞘少突胶质细胞糖蛋白的免疫优势表位,能够诱导强烈的T细胞和B细胞应激反应,具高度致脑炎性,能够诱导啮齿类动物的实验性白身免疫性脑脊髓炎(EAE)模型。EAE是**普遍的MS动物模型,具有MS许多的临床和病理生理学特征。单次注射MOG(35-55)能够产生一种复发-缓解型神经性疾病,表现出大量斑块状脱髓鞘病症。1-甲基-4-苯基-1,.2,3,6-四氢吡啶(MPTP)诱导的多巴胺神经元损伤模型,免疫接种MOG(35-55)能抑制该神经元的白发再生功能。重庆比较好的eae模型T细胞更易通过血脑屏障作用于神经髓鞘)建立EAE模型。
EAE模型的发展与年龄密切相关。幼龄动物发病后症状很快达到高峰,随后又迅速恢复,和成年动物相比病程较短,其抗原注射部位及CNS内的炎性细胞浸润程度较轻,并且幼龄动物体重偏小,一般情况差,易出现麻醉意外而死亡。若动物体重(周龄)偏大,则发病延迟,且症状较重,所以选择受试动物以青年期为佳。但若作为抗原提供者,其年龄可适当放宽,一般大于4周即可。MS多为青年女性,EAE的发生也存在性别差异。一般来讲,雌性动物较雄性敏感,表现在雌性动物的发病率高,临床症状相对严重,如Wistar大鼠及SJL/J小鼠,但也有的动物如Lewis大鼠,雄性较雌性敏感。另外实验时间选择在夏季比冬春季节诱导动物模型的敏感性更高。敏感性高的动物,有时症状较严重且死亡率高,应引起注意。
从鸟类到哺乳类的多种动物如鸡、小鼠、大鼠、豚鼠、家兔、羊、犬、猴等均可成功诱发EAE,但不同种属或同一种属不同品系动物的敏感性有很大差异。对EAE敏感的动物有Lewis、DA大鼠,PL/J、SJL/J小鼠,Hartley、Strain13豚鼠。虽然豚鼠对诱发EAE相当敏感,但其品系复杂,有关试剂缺乏,一般不常用作实验对象。相比之下大鼠及小鼠的背景知识及相关试剂则较为普遍,遗传学、免疫学等方面的研究也较深入,且其EAE在临床、病理、免疫及生化改变等方面都与人类脱髓鞘疾病较为相似,因此应用比较为普遍。EAE能再现MS的很多临床和病理特征。
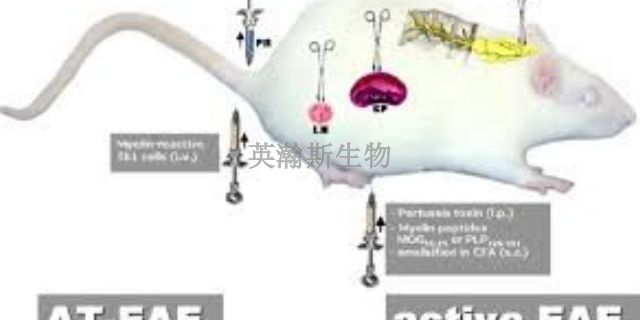
科学家们可以通过精心调控EAE动物模型的免疫反应,深入研究免疫疗法在多发性硬化症(MS)疗愈中的潜在应用。在EAE动物模型中,科学家们能够模拟MS患者体内免疫系统的异常反应,并通过一系列实验手段,精细地调控免疫细胞的活性、数量和功能。通过观察调控免疫反应后EAE动物模型的病情变化,科学家们能够评估不同免疫疗法对MS的疗愈效果,并探索其背后的作用机制。这一研究不仅有助于揭示MS的发病机制,还为开发新的免疫疗法提供了重要的实验依据。因此,通过调控EAE动物模型的免疫反应来研究免疫疗法在MS疗愈中的应用,对于推动MS的疗愈进展具有重要意义。EAE模型的诱导有主动诱导法和被动诱导法两种。安徽推荐的eae模型有哪家
MOG是目前常用建立EAE模型的髓鞘抗原,多以诱发慢性EAE(Chronic EAE)模型。湖南小鼠eae模型实验外包
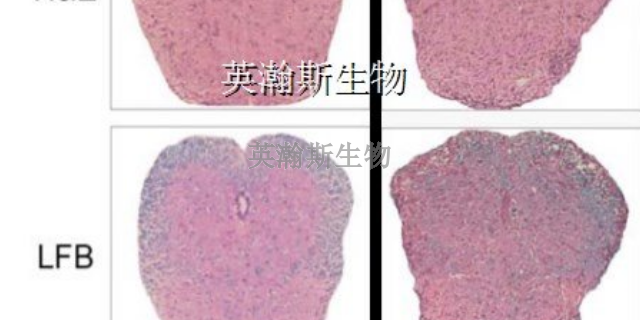
利用EAE动物模型,科学家们能够深入研究多发性硬化症(MS)患者可能出现的神经系统功能障碍及其康复机制。这一模型不仅模拟了MS在人体内的病理过程,还使得我们可以在控制实验条件的情况下,观察和研究神经系统受损后的功能变化。通过对比正常动物与EAE模型动物在行为、感觉和运动等方面的差异,我们可以揭示MS患者可能出现的神经系统功能障碍的具体表现,并探究这些功能障碍背后的神经生物学机制。同时,利用EAE动物模型,我们还可以测试不同的康复疗愈方法,评估它们对神经系统功能恢复的效果,为MS患者的康复疗愈提供科学依据。因此,利用EAE动物模型研究MS患者的神经系统功能障碍及其康复机制,对于改善MS患者的生活质量具有重要意义。