- 品牌
- MCE,艾德莱,OriGene,abmart,ABW基质胶
为克服传统基质胶的局限性,新型替代材料的研究取得了重要进展。脱细胞组织基质(dECM)保留了组织特异性ECM组成,显著提高了类的组织相似性。合成水凝胶系统(如PEG、HA基水凝胶)具有成分明确、可调控性强的优势,可通过引入特定肽段(如RGD)来模拟天然ECM的功能。温敏性水凝胶(如PNIPAM)实现了温和的细胞收获。此外,生物3D打印技术结合智能材料,可以构建具有复杂结构的仿生支架。这些新材料不仅提高了实验的可重复性,还为个性化医疗和规模化培养提供了可能。基质胶的光固化特性可用于构建空间受限的类器官培养体系。高成功率基质胶-类器官培养
在类***培养中,基质胶作为支撑材料,提供了细胞生长所需的三维微环境。研究表明,基质胶能够有效促进干细胞向特定类型细胞的分化,从而形成具有特定功能的类***。例如,在肠道类***的培养中,基质胶为肠道上皮细胞的增殖和分化提供了理想的环境,促进了类***的形成和成熟。此外,基质胶中的生物活性因子能够调节细胞的信号传导通路,进一步增强类***的生长和功能。这种三维培养系统不仅提高了细胞的存活率,还能够更好地模拟体内的细胞间相互作用,为研究***功能和疾病机制提供了重要的实验平台。衢州基质胶-类器官培养价格查询基质胶的电纺丝改性可提高类器官培养的仿生性。
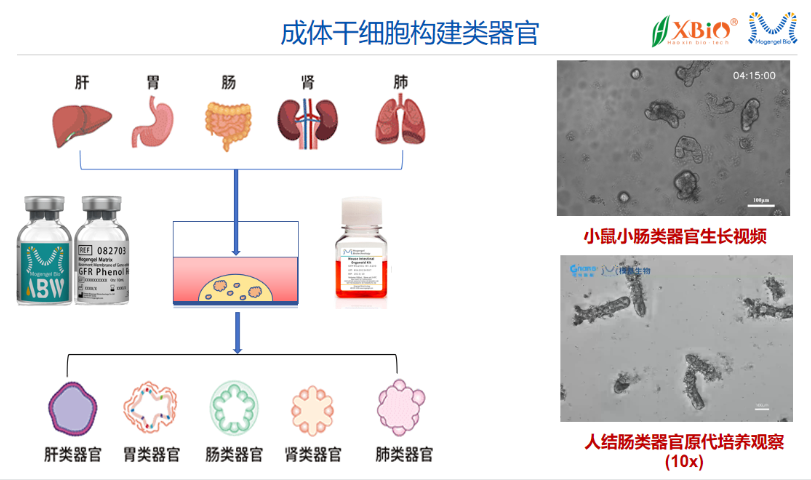
未来,基质胶与类的研究将朝着多个方向发展。首先,研究者将继续探索基质胶的改良,以开发出更具生物相容性和功能性的材料,满足不同类型细胞的培养需求。其次,结合生物工程技术,利用3D打印等先进技术构建更复杂的类模型,将为研究提供更高的空间和时间分辨率。此外,基于类的高通量筛选平台将有助于加速药物发现和疾病研究。蕞后,随着基因编辑技术的发展,类将成为研究基因功能和疾病机制的重要工具。通过这些研究方向的推进,基质胶和类的结合将为生物医学研究开辟新的前景。
基质胶的生化组成直接影响类的发育方向和功能成熟度。天然基质胶(如Matrigel)虽然含有丰富的生长因子和ECM蛋白,但存在批次差异大的问题。为此,研究人员开发了多种优化策略:添加特定生长因子(如EGF、FGF等)来促进特定谱系分化;补充组织特异性ECM成分(如层粘连蛋白用于上皮类);或者使用重组蛋白构建成分明确的合成基质。的研究还关注基质胶中细胞因子的时空分布,通过构建生长因子梯度或开发刺激响应性释放系统,更好地模拟体内发育过程中的动态微环境。类器官培养中需避免基质胶过度交联导致营养渗透受阻。

基质胶培养的类***为疾病研究提供了**性的模型系统。在**研究领域,患者来源类***(PDOs)保留原发**的组织结构和分子特征,已成为个性化医疗的重要工具。通过调节基质胶的硬度可以模拟不同阶段的**微环境,如较硬的基质(~8kPa)可诱导乳腺*的侵袭表型。在遗传性疾病研究中,囊性纤维化类***模型可以重现CFTR基因突变导致的病理变化。***进展是将基质胶类***与微流控系统结合,构建包含血管网络的复杂疾病模型,这为研究**转移和药物渗透提供了更真实的平台。此外,基质胶的组成调控还可以模拟特定病理条件下的ECM重塑,如肝纤维化中胶原沉积的增加。基质胶中TGF-β的缓释可增强类器官的基质细胞共培养效果。杭州基质胶-类器官培养销售价格
类器官与基质胶的共聚焦成像需优化荧光标记策略。高成功率基质胶-类器官培养
基质胶优化策略提升类成熟度提高类功能成熟度需对基质胶进行成分与结构优化:添加ECM组分:如纤连蛋白、透明质酸增强细胞黏附;生长因子梯度:梯度释放VEGF、WNT等诱导血管化或极性分化;动态刚度调节:利用光响应水凝胶模拟发育过程中的力学变化。例如,在脑类器官培养中,通过分阶段调整基质胶刚度,可促进神经前体细胞的区域化分化,更接近体内脑组织的复杂性。无基质胶类器官培养的替代方案为减少对动物源性基质胶的依赖,研究者开发了多种替代方案:合成多肽水凝胶(如RGD修饰)提供明确的细胞黏附位点;脱细胞ECM支架:保留组织特异性ECM成分;悬浮培养系统:通过低吸附板或微载体实现无胶3D生长(如类)。这些方案可降低批次差异,但需验证其对类形态和功能的影响,尤其是对干细胞干性的维持能力。高成功率基质胶-类器官培养
- 细胞迁移与分化基质胶-类器官培养性价比高 2025-12-04
- 西湖区细胞迁移与分化基质胶-类器官培养如何申请试用 2025-12-04
- 西湖区免疫共培养基质胶-类器官培养怎么试用 2025-12-04
- 浙江细胞迁移与分化基质胶-类器官培养谁家好 2025-12-04
- 江苏基质胶-类器官培养特价 2025-12-04
- 富阳区基质胶-类器官培养谁家好 2025-12-03
- 多层基质胶-类器官培养怎么试用 2025-12-03
- 浙江肿瘤基质胶-类器官培养实验步骤 2025-12-03