小鼠的免疫功能特性:小鼠淋巴系统特别发达,外界刺激可使淋巴系统增生,因此易患淋巴系统疾病。小鼠无扁桃体,胸腺在性成熟时比较大,骨髓为红髓,终生造血。对多种病毒和病原体易感。对致症状物敏感,自发性**症状多。小鼠的发情识别一般通过观察母鼠阴道的颜色、湿度、肿胀程度来判定小鼠的日常各项指标:性成熟年龄:雌鼠42-56日龄,雄鼠56-70龄•雌鼠性周期:4天左右•妊娠期:19-21天•哺乳期:19-21天•离乳期:19-21天•平均窝产仔:5-10只,年产6-10胎•出生重:1.0-1.5克•断奶重:8-10克•睁眼采食日龄:12-13天•平均寿命:2年•日耗料:4-5克•日饮水量:4-7ml•日尿量:1-2ml卡文斯实验鼠配套提供病理检测、基因型鉴定等增值服务。GK大鼠供货时间
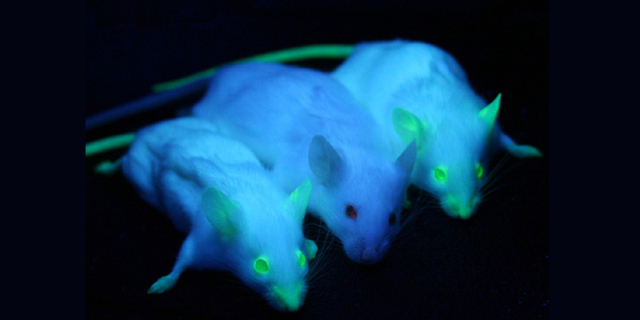
品系名称:5OD1-G93A(肌萎缩侧索硬化)品系编号:D000051品系背景:C57BL/6J品系描述:50D1-G93A转基因小鼠表达人类50D1(超氧化物歧化酶1)的G93A突变形式(在密码子93处具有甘氨酸到丙氨酸的单个氨基酸取代),由其内源性人S0D1启动子驱动。转基因半合子小鼠是可存活的和可育的,半合子表现出类似于人类肌萎缩侧索硬化症(ALS)的表型,由于脊运动神经元的丧失,导致一个或多个肢体痢痪。运动神经元退化与星形胶质细胞的功能或退化有关,星形胶质细胞是神经系统的主要神经胶质细胞类型。转基因小鼠的寿命较短:50%在157.1+9.3天存活。雌性半合子繁殖能力比较差,在发病前很少生产超过一窝。应用领域:研究神经肌肉疾病,例如肌萎缩侧索硬化症(ALS或LouGehrig病)。ob/ob小鼠饲养管理常州卡文斯实验鼠运输全程温控,保障动物健康状态。
小鼠的抓取固定1.小鼠的抓取(1)右手提起小鼠尾巴,将其放在鼠笼盖或其他粗糙表面上(2)小鼠向前挣扎爬行时,再用左手拇指和食指抓住鼠耳和颈部皮肤抓取固定时需注意:过分用力,会使动物窒息或颈椎脱臼;用力过小,动物头部能反转来咬伤实验者的手。因此实验者必须反复练习,熟练掌握。2.小鼠的固定(1)徒手固定用右手抓取鼠尾提起,置于鼠笼或实验台向后拉,在其向前爬行时,用左手拇指和食指抓住小鼠的两耳和颈部皮肤,将鼠体置于左手心中,把后肢拉直,以无名指按住鼠尾,小指按住后腿即可。固定板固定鼠麻醉后置小鼠固定板上,取仰卧位,用胶布缠粘四肢,再用针透过胶布扎在板上,从而将小鼠固定在小鼠固定板上。(3)固定架固定让小鼠直接钻入固定架里,封好固定架的封口,露出尾巴。此装置特别适用于小鼠尾静脉注射等。
WISTAR大鼠主要用途:多用于肿块瘤体、免疫、药理、内分泌。简介:1907年由美国维斯塔尔(Wistar)研究所育成,现己遍及世界各国的实验室。我国从日本及前苏联引进,是引进较早、使用较广阔、数量较多的大鼠品系之一。特点:远交系大鼠,头部较宽、耳朵较长、尾的长度小于身长。性周期稳定,繁殖力强,产仔多,平均每胎产仔在10只左右,生长发育快。10周龄时雄鼠体重可达280~300g,雌鼠达170-260g。性情温顺。对传染病的抵抗力较强。自发性肿块瘤体发生率低。目前各地饲养的Wistar大鼠的遗传状况差异较大。卡文斯实验鼠在免疫缺陷模型应用中广受科研机构好评。

实验鼠是指经人工培育,对其携带的微生物和寄生虫实行控制,遗传背景明确或者来源清楚,用于科学研究、教学、生产、检定以及其他科学实验的老鼠。实验鼠包括大鼠、小鼠、地鼠、豚鼠等,具有成熟早、繁殖能力强、对外来刺激敏感等特点。实验鼠是继人类之后第二种完成全基因组测序的哺乳动物,其基因组与人类高度同源,生理生化及生长发育的调控机理和人类基本一致,同时具有繁殖能力强、世代周期短、饲养成本低等特点,是目前应用较为广阔的实验动物之一,其他实验动物还包括实验猴子、实验兔子、实验猪等。随着基因工程技术的发展,特别是近年来以CRISPR/Cas9为首的基因编辑技术的普遍运用,使得大规模生产实验鼠成为可能,从而可以更加精细地模拟人类特定生理病理特征,在阐明生命机理规律、疾病诊断诊治完成完成疗程以及新药创制研发等方面具有不可替代的作用。卡文斯实验鼠在老年病学研究中的建模效果明显。肌萎缩侧索硬化小鼠技术指导
常州卡文斯实验鼠在心血管疾病研究领域具有优异建模能力。GK大鼠供货时间
腹腔注射操作步骤:1.抓取小鼠一般都是放在饲养笼上,提其尾巴中部,水平偏下往后轻拉,小鼠爪子会自然会抓住笼子,此时应该迅速抓住小鼠的颈背部的皮毛,比较好是抓在小鼠的耳朵处,这样可以更好固定小鼠的头部,以防被咬。但是,切记力气不要过大,容易使小鼠窒息。再将小鼠的尾巴用左手无名指或小拇指固定,这样就可以将小鼠整个躯干固定好,注意一定要让小鼠处于一个舒服的身身体部位置,如果小鼠躯干不能保持竖直,很容易扎到脏器,引起出血,影响实验。2.注射抓取小鼠后,应腹部向上,头呈低位。头呈低位可以使得脏器移至低位,避免扎伤。右手持注射器,插入小鼠腹部,注射部位为小鼠后肢根部连线处任一侧1.5cm处,缓慢以45度左右进针,进针深度小于1cm,进针的感受为局部皮肤凹陷消失和落空感。3.拔针:为了防止漏液,轻微旋转针头,再缓缓拔出。在实验前,准备酒精棉球,注射器在使用后要消毒才能给下一只小鼠使用,避免交叉染上。此外,注射前,也可以用酒精棉球擦拭小鼠皮肤,可以明显辨别药物是否注射到腹腔,如果看到鼓包,就是注射到皮下了。GK大鼠供货时间