- 产地
- 苏州
- 品牌
- 鼠尾胶原
- 型号
- 齐全
- 是否定制
- 是
实验应用:鼠尾胶原在原代培养耳蜗血管纹边缘细胞中的应用。目的:建立利用自制的鼠尾胶原培养大鼠耳蜗边缘细胞的方法。方法:制作鼠尾胶原,并观察利用自制的鼠尾胶原所培养出大鼠耳蜗边缘细胞的效果。结果:自制的鼠尾胶原能正常地培养出大鼠耳蜗边缘细胞,细胞角蛋白18表达阳性,免疫组织化学结果和扫描电镜证实所培养的细胞具有典型的分泌上皮细胞特征。结论:成功建立了利用自制鼠尾胶原培养大鼠耳蜗边缘细胞的方法,并且制作简便,成本低廉。制备鼠尾胶原:离心,4000转/分,10-15分钟。唐山鼠尾胶原哪家便宜

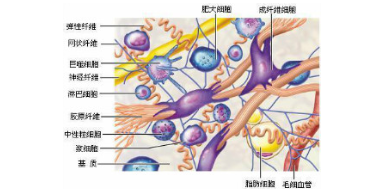
胶原蛋白的应用:1.胶原天然的紧密的纤维结构,使胶原材料显示出很强的韧性和强度,适用于薄膜材料的制备;2.大较胶原被用作制造肠衣等可食用包装材料.其独特之处是:在热处理过程中.随着水分和油脂的蒸发和熔化.胶原几乎与肉食的收缩率一致。而其他的可食用包装材料还没被发现具有这品质;3.由于胶原分子链上含有大量的亲水基团. 所以与水结合的能力很强. 这一性质使胶原在食品中可以用作填充剂和凝胶;4.胶原在酸性和碱性介质中膨胀,这一性质也应用于制备胶原基材料的处理工艺中。南京武汉鼠尾胶原它是研究成纤维细胞与细胞外基质之间以及细胞之间相互作用的良好模型。
胶原蛋白的提取方法:酶法提取:酶法提取是利用蛋白酶使胶原溶解,水解条件温和,反应速率快,提取的胶原蛋白仍有完整的三股螺旋结构,蛋白纯度高,理化性质稳定,且无环境污染。酶法提取常用的蛋白酶有:胃蛋白酶、胰蛋白酶或者复合酶。工艺可选择一步法,即利用酶液直接提取;二步法,即先用酸或者碱进行初步提取,然后再用酶提取。Langmaier等[6]用MgO预处理革屑,然后用碱性蛋白酶提取胶原的水解产物。Cabeza L.F.T等[7]先用胃蛋白酶,再用碱性蛋白酶提取了2种不同的胶原水解产物。赵苍碧等[2]采用胃蛋白酶和无花果蛋白酶消化法从牛腱中提取胶原蛋白,探讨了酶和酶的加入量对提取结果的影响,给出了酶对胶原提取较佳工艺配比,酶与牛腱的质量比为0.1时效果较佳,而使用无花果蛋白酶时,0.01的配比较佳。
简介:鼠尾I型胶原蛋白(Collagenfromrattail,TypeI)系采用Birkedal-Hansen方法在无菌下制备,纯度达到95%以上,可溶于0.006mol/L乙酸。本品可用于细胞培养皿的包被,特别适合普通细胞培养器皿不易贴壁细胞的培养;也可用于制备三维胶原凝胶,使细胞在模拟的三维环境中生长。质量标准:1、SDS-PAGE分析纯度大于95%。2、无菌检验结果为阴性。3、本品2μg/cm2包被细胞培养皿后培养PC-12细胞,贴壁及生长正常。4、本品浓度1mg/mL,pH7.0时形成具有一定强度的三维胶原凝胶,NIH-3T3细胞在三维凝胶内生长正常、PC-12细胞在三维凝胶表面生长正常。鼠尾胶原醋酸溶解:按照6-10ug/cm2的浓度包被培养瓶。
鼠尾胶原蛋白I型,用那一种胶原酶可以溶解:1.将胶原加入到0.1M 的醋酸中,制备成浓度为0.1%的溶液。在室温中搅拌1-3小时直到完全溶解。2.建议将溶液转移到拧口的玻璃瓶中,并小心的在瓶底铺上一层氯仿。氯仿的量约为胶原溶液的10%。不要晃动或搅拌。在2-8度中放置过夜。在无菌条件下转移上层的胶原溶液。我们不建议用过滤的方法无菌化。已经发现该方法会导致丢失蛋白。3.稀释一定数量的胶原溶液。 4.按照6-10ug/cm2的浓度包被培养瓶。在室温或37度结合数小时或者2-8度过夜。5.从包被表面除去多余的液体。过夜干燥。如果胶原溶液不是无菌的,这时候可以在无菌细胞操作室中暴光在紫外线下过夜消毒。 在接种细胞前用无菌的水漂洗。鼠尾胶原醋酸溶解:在室温中搅拌1-3小时直到完全溶解。宁波昆明鼠尾胶原
鼠尾胶原能促进毛细胞贴壁,涂布鼠尾胶原有利于膜片钳实验长时程的记录。唐山鼠尾胶原哪家便宜
鼠尾胶原在心肌细胞氧化损伤中的保护作用:原蛋白具有抗氧化作用,但既往在实验室主要将鼠尾胶原用于促进细胞贴壁和支架构建,对于其抗氧化作用目前尚无相关研究。目的:探讨鼠尾胶原对过氧化氢导致离体心肌细胞氧化损伤的保护作用。方法:将原代培养的SD大鼠乳鼠心肌细胞随机接种到铺有鼠尾胶原的培养皿(实验组)和普通培养皿(对照组)中,并且均用0,10,100μmol/L H2O2诱导。24 h后,以电子显微镜观察各组乳鼠心肌细胞的形态,应用MTT比色法检测心肌细胞存活率,TUNEL法检测心肌细胞凋亡形态,流式细胞技术检测心肌细胞凋亡率,黄嘌呤氧化酶法检测超氧化物歧化酶活力,硫代巴比妥比色法检测丙二醛水平,Western-Blot检测凋亡蛋白Bax、Bcl-2的表达。唐山鼠尾胶原哪家便宜
鼠尾胶原简介:鼠尾I型胶原蛋白(Collagenfromrattail,TypeI)系采用Birkedal-Hansen方法在无菌下制备,纯度达到95%以上,可溶于0.006mol/L乙酸。本品可用于细胞培养皿的包被,特别适合普通细胞培养器皿不易贴壁细胞的培养;也可用于制备三维胶原凝胶,使细胞在模拟的三维环境中生长。质量标准:1、SDS-PAGE分析纯度大于95%。2、无菌检验结果为阴性。3、本品2μg/cm2包被细胞培养皿后培养PC-12细胞,贴壁及生长正常。4、本品浓度1mg/mL,pH7.0时形成具有一定强度的三维胶原凝胶,NIH-3T3细胞在三维凝胶内生长正常、PC-12细胞在三维凝胶...
- 深圳正规鼠尾胶原直销厂家 2026-03-08
- 成都正规鼠尾胶原产品介绍 2026-03-08
- 无锡鼠尾胶原供应商 2026-03-08
- 杭州济南鼠尾胶原 2026-03-08
- 广州正规鼠尾胶原单价 2026-03-07
- 宁波鼠尾胶原单价 2026-03-07
- 天津鼠尾胶原厂家供应 2026-03-07
- 南昌正规鼠尾胶原生产厂家 2026-03-07
- 广州正规鼠尾胶原供应商 2026-03-07
- 贵阳正规鼠尾胶原厂家 2026-03-07
- 上海正规鼠尾胶原销售厂家 2026-03-05
- 石家庄正规鼠尾胶原平均价格 2026-03-05
- 南京鼠尾胶原厂家推荐 2026-03-05
- 温州鼠尾胶原厂家现货 2026-03-04
- 珠海鼠尾胶原厂家 2026-03-04
- 正规鼠尾胶原推荐厂家 2026-03-04


- 江西正规糖原染色试剂盒销售厂家 03-08
- 成都正规细胞外基质胶服务电话 03-08
- 杭州外泌体提取试剂哪里买 03-08
- 北京正规RNA提取试剂报价 03-08
- 杭州开封原代细胞分离试剂盒 03-08
- 江西提供糖原染色试剂盒销售厂家 03-08
- 南京正规无血清细胞冻存液厂家现货 03-08
- 珠海RNA提取试剂厂家推荐 03-08
- 深圳正规鼠尾胶原直销厂家 03-08
- 济南正规无血清细胞冻存液销售厂家 03-08